ANEXT安龄生物·外泌体每周速递036
ANEXT安龄生物·工程化细胞外囊泡助力缓解急性肺损伤小鼠肺部炎症
ANEXT安龄生物·间充质干细胞来源的细胞外囊泡研究进展及其展望
1、细胞外囊泡改善亨廷顿舞蹈症(HD)衍生神经元中的GABA能传递
来自葡萄牙科英布拉大学的研究人员建立了人类HD模型并评估了细胞外囊泡(EVs)对GABA能突触改变的影响,发现HD来源的神经元表现出突触标记物的抑制和GABA受体介导的离子性信号传导密度的降低。成纤维细胞分泌的EVs治疗可以逆转GABA能突触传递的缺陷,并增加HD来源的多能干细胞分化而来的神经元培养物中的抑制性突触的密度。最后对纯化EVs的miRNA进行分析,发现了一组具有预测突触靶点的差异表达miRNA。相关内容以“Extracellular vesicles improve GABAergic transmission in Huntington's disease iPSC-derived neurons”为题,发表在国际综合性医学学术期刊Theranostics杂志上。
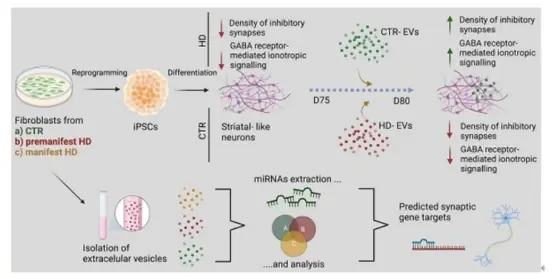
在这项研究中,研究团队将人诱导多能干细胞分化为电生理活跃的纹状体样GABA能神经元。根据课题组先前的疾病分期特征,研究人员利用成纤维细胞分泌的EVs去处理纹状体样神经元。用对照组(CTR)成纤维细胞分泌的EVs治疗HD患者来源的纹状样神经元后,研究人员观察到神经元GABA能信号的改善。相反,由HD来源的成纤维细胞分泌的EVs在CTR神经元上产生相反的结果,这表明EVs在细胞毒性效应的传播和影响神经元功能方面发挥了作用。此外,研究人员在HD-EVs和CTR-EVs中观察到不同的miRNA谱,证明EVs-miRNA可能作为突触相关蛋白的调节因子并参与HD病理进展。
2、哈佛首次报道动脉组织EV多组学,揭示EVs与心血管钙化相关性
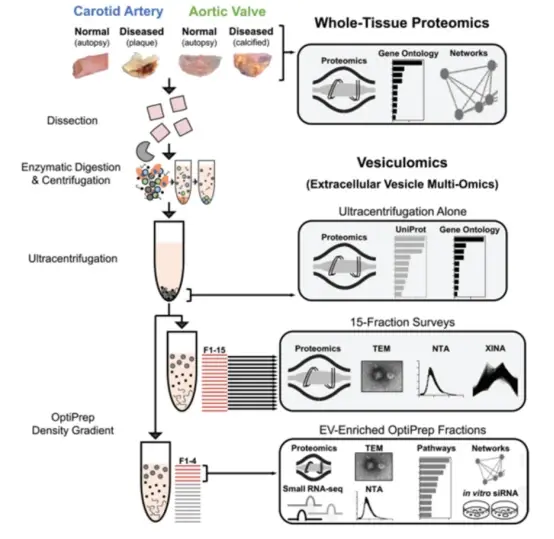
近日,来自哈佛医学院的Elena Aikawa研究组在Circulation杂志上发表文章,首次报道了针对人类颈动脉斑块和钙化主动脉瓣的比较蛋白质组学研究,确定了动脉粥样硬化与主动脉瓣狭窄的独特驱动因素,并表明EVs与晚期心血管钙化有关。

该研究解决了围绕人类动脉粥样硬化动脉和狭窄主动脉瓣钙化差异发病机制的持续不确定性。由于与血管和瓣膜疾病有关的细胞类型的病理性EV分泌,作者假设组织包埋的囊泡货物有助于心血管钙化的共享和组织特异性调节。利用整体蛋白质组学,检查了人类颈动脉斑块和钙化主动脉瓣内疾病的3个不同阶段,确定了动脉粥样硬化与主动脉瓣狭窄的独特驱动因素,以及两种组织疾病进展中与EV相关的途径。在蛋白质组学的指导下,开发了一种EV分离方法,该方法使用酶消化、顺序离心、超速离心和密度梯度分离来从纤维钙化人体组织中富集EV。最后,我们通过应用蛋白质组学、小RNA测序、多组学整合、多维网络分析和系统方法来研究正常和患病的心血管组织囊泡组,以从组织EV货物中获得生物学见解。在此过程中,评估了EV作为血管和瓣膜钙化独特发病机制的调节剂。
3、血小板衍生细胞外囊泡在药物递送领域的研究进展
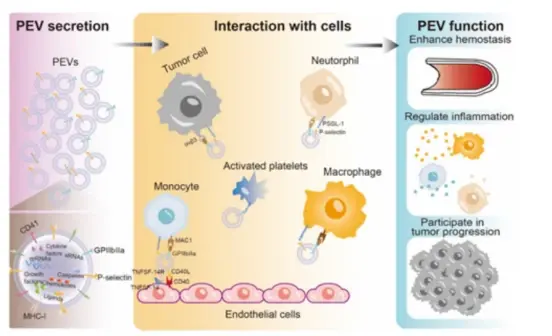
近日,苏州大学功能纳米与软物质研究院的汪超团队在Biomaterials Science发表了题为“Platelet-derived extracellular vesicles for drug delivery”的邀请综述。文章首先总结了PEVs的结构、生物合成、分泌及其在多种疾病进展中生物功能。
在各种细胞外囊泡中,PEVs是最丰富的细胞外囊泡之一,血液中超过50%的细胞外囊泡来自血小板和巨核细胞。PEVs从活化的血小板中释放出来,表面带有CD41,P-选择素和其他血小板特异性蛋白,由于这些特定的蛋白,PEVs可以在实现血小板的部分功能,包括止血、免疫调节和肿瘤进展。它们还可以介导与不同细胞的相互作用,包括免疫细胞和非免疫细胞。文章作者总结了PEVs的结构特性、生物发生、分泌过程,并阐述了PEVs的生物学功能。主要强调了PEVs介导的细胞通讯以及PEVs在止血、炎症性疾病和肿瘤进展中的作用。
文章总结了利用PEVs作为药物递送系统的挑战。例如,PEVs 的表征具有广泛的异质性,为确保PEVs制剂的质量,应采取一系列质控措施;其次,如何进一步大规模生产PEVs,也是进一步发展基于PEVs药物递送载体的挑战。最后,研究人员也可以利用合成生物学的策略,对巨核细胞或血小板进行修饰,赋予PEVs更多的功能。
4、肿瘤间充质干细胞诱导脑胶质瘤免疫耐受新机制
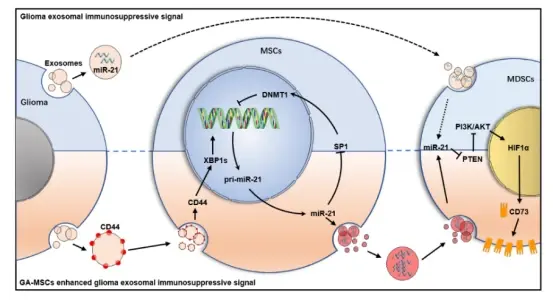
近日,山东大学齐鲁医院李刚教授、薛皓副教授团队于Journal of Nanobiotechnology发表了题为“Mesenchymal stem cells, as glioma exosomal immunosuppressive signal multipliers, enhance MDSCs immunosuppressive activity through the miR-21/SP1/DNMT1 positive feedback loop”的研究论文。该研究发现胶质瘤微环境中的肿瘤相关间充质干细胞(Ta-MSC)能够作为信号放大器,放大胶质瘤外泌体的免疫抑制信号,通过增强髓系抑制细胞(MDSC)的免疫抑制能力促进胶质瘤恶性进展。

该研究发现胶质瘤相关MSC通过传递外泌体miR-21促进MDSC表达CD73,促进免疫抑制微环境的形成,这一过程与该团队前期研究中发现的胶质瘤外泌体直接传递miR-21增强MDSCs免疫抑制能力相似,但作用更强。进一步研究发现,胶质瘤来源的外泌体传递CD44蛋白促进MSC内质网应激,导致下游XBP1s蛋白含量升高,作为转录因子促进miR-21表达,而MSC中上调的miR-21又通过SP1/DNMT1通路降低miR-21启动子区域的DNA甲基化水平,通过正反馈环路进一步促进miR-21的高表达,导致MSC外泌体中的miR-21显著上调,增强MDSCs的免疫抑制能力以及促进胶质瘤恶性进展。此外,研究还发现使用改造后的树突状细胞DC来源的外泌体装载miR-21 inhibitor能够通过抑制MSC中的正反馈环路抑制免疫微环境的形成,并可与抗PD-1抗体联用抑制胶质瘤恶性进展。